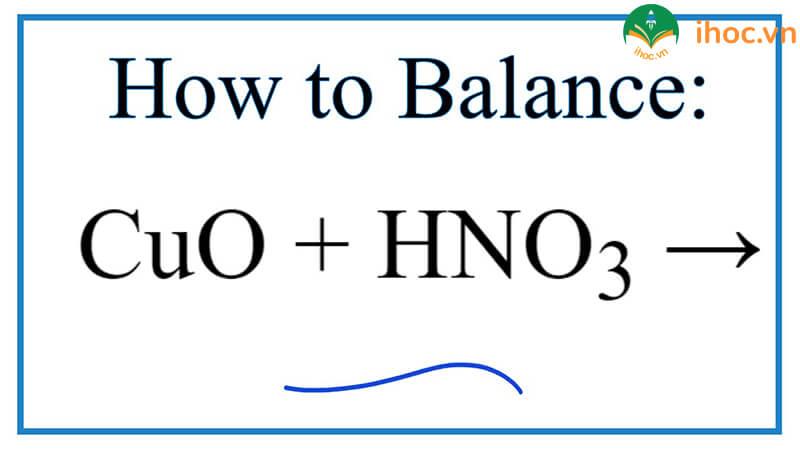
Khám phá phản ứng HNO3 + CuO: Mối quan hệ giữa hai chất hóa học quan trọng
Trong quá trình học tập về hóa học, chúng ta thường gặp phải nhiều phản ứng hóa học thú vị và hấp dẫn. Hôm nay, chúng ta sẽ khám phá phản ứng HNO3 + CuO. Đây là một trong những phản ứng phổ biến và hữu ích mà chúng ta nên nắm vững. Các bạn hãy cùng ihoc tìm hiểu nhé!
Axit nitric (HNO3) là một trong những axit quan trọng và phổ biến nhất trong hóa học. Được biết đến với tên gọi “axit nitric,” nó là một chất oxi hóa mạnh có khả năng tác động lên nhiều loại chất hữu cơ và vô cơ.
Công thức hóa học của HNO3 là HNO3, trong đó H đại diện cho nguyên tử hydro, N đại diện cho nguyên tử nitơ và O đại diện cho nguyên tử oxi.
Tính chất của axit nitric:
Oxit đồng (CuO) là một hợp chất vô cơ của đồng với oxi, được tạo thành khi đồng tác động với oxi hoặc khi oxi hoá đồng.
Công thức hóa học của CuO là CuO, trong đó Cu đại diện cho nguyên tử đồng và O đại diện cho nguyên tử oxi.
Tính chất của oxit đồng:
Axit nitric (HNO3) và oxit đồng (CuO) có mối quan hệ trong phản ứng hóa học, nơi HNO3 tác động lên CuO để tạo ra các sản phẩm mới.
Phản ứng giữa HNO3 và CuO:
Khi HNO3 tác động lên CuO, các nguyên tử oxi trong CuO được cấp electron bởi HNO3, tạo thành các ion nitrat (Cu(NO3)2) và nước (H2O).
Tìm hiểu về axit nitric (HNO3) và oxit đồng (CuO) giúp chúng ta hiểu rõ hơn về tính chất và phản ứng hóa học của chúng, đồng thời khám phá những ứng dụng quan trọng trong cuộc sống và các lĩnh vực công nghiệp khác.
Tìm hiểu thêm: NaCl ra Na: Tìm hiểu về phản ứng hoá học đặc biệt của muối natri
Phản ứng giữa axit nitric (HNO3) và oxit đồng (CuO) được biểu diễn bằng phương trình hóa học sau:
Xem thêm : 100 tiền Campuchia đổi sang Việt Nam bao nhiêu
Phản ứng giữa HNO3 và CuO là một phản ứng oxi hóa – khử. Trong quá trình này, axit nitric (HNO3) tác động lên oxit đồng (CuO), chuyển đổi các nguyên tử trong cấu trúc của chúng và tạo ra các sản phẩm mới.
Chi tiết cơ chế phản ứng:
Khi axit nitric (HNO3) tác động lên oxit đồng (CuO), cơ chế phản ứng xảy ra như sau:
Sản phẩm chính của phản ứng giữa HNO3 và CuO là muối đồng nitrat (Cu(NO3)2) và nước (H2O).
Phản ứng giữa HNO3 và CuO là một ví dụ minh họa về cơ chế oxi hóa – khử trong hóa học. Điều này giúp chúng ta hiểu rõ hơn về quá trình phản ứng hóa học giữa các chất và tính chất của sản phẩm tạo thành.
Xem thêm: Phản ứng AlCl3 NH3: Cơ chế, ứng dụng và tính chất hóa học
Phản ứng giữa axit nitric (HNO3) và oxit đồng (CuO) có một số liên hệ quan trọng với cuộc sống hàng ngày của chúng ta:
Phản ứng giữa HNO3 và CuO cũng có một số tác dụng quan trọng trong công nghiệp và môi trường:
Tóm lại, phản ứng giữa HNO3 và CuO không chỉ có ứng dụng trong cuộc sống hàng ngày của chúng ta như trong sản xuất muối đồng nitrat, mà còn có tác dụng quan trọng trong công nghiệp và môi trường. Hiểu rõ về các tác dụng này giúp chúng ta nhận thức được sự quan trọng và tác động của phản ứng hóa học trong cuộc sống và môi trường xung quanh.
Hướng dẫn cụ thể và an toàn khi thực hiện thí nghiệm HNO3 + CuO:
Lưu ý quan trọng: Phản ứng giữa axit nitric (HNO3) và oxit đồng (CuO) là một phản ứng hóa học mạnh mẽ và cần được thực hiện dưới sự hướng dẫn của giáo viên hoặc người có kinh nghiệm trong môi trường phòng thí nghiệm.
Thực hiện thí nghiệm:
An toàn khi thực hiện:
Kết quả thí nghiệm và cách quan sát:
Quan sát kết quả thí nghiệm sau khi phản ứng xảy ra rất quan trọng để hiểu rõ cơ chế phản ứng và tính chất của sản phẩm. Sau khi kết thúc thí nghiệm, đảm bảo thu gom và xử lý an toàn chất thải phản ứng theo quy trình hợp lý.
Xem thêm : Ngâm tỏi trong rượu trắng có tác dụng gì?
Bài tập 1: Xác định lượng Cu(NO3)2 và H2O tạo thành sau khi phản ứng 16g HNO3 với 20g CuO.
Giải:
Ta sử dụng phương trình phản ứng: HNO3 + CuO → Cu(NO3)2 + H2O
Xác định số mol của từng chất:
Phản ứng HNO3 và CuO theo tỉ lệ số mol là 1:1. Vì số mol của HNO3 và CuO gần nhau, nên phản ứng sẽ xảy ra hoàn toàn, không dư dùng chất nào.
Vậy, sau phản ứng, ta thu được 0.254 mol Cu(NO3)2 và 0.254 mol H2O.
Trong một bài thí nghiệm hóa học, bạn đang nghiên cứu về phản ứng giữa HNO3 và CuO. Bạn đã chuẩn bị 15g HNO3 và 10g CuO để thực hiện phản ứng.
Sau khi phản ứng diễn ra, bạn quan sát thấy một hiện tượng phát nhiệt xảy ra và màu xanh lá cây của muối đồng nitrat (Cu(NO3)2) được hình thành. Bạn muốn xác định lượng Cu(NO3)2 và H2O tạo thành sau khi phản ứng hoàn tất.
Giải:
Sử dụng phương trình phản ứng: HNO3 + CuO → Cu(NO3)2 + H2O
Xác định số mol của từng chất:
Phản ứng HNO3 và CuO theo tỉ lệ số mol là 1:1. Vì số mol của HNO3 lớn hơn số mol của CuO, nên CuO sẽ hết trong phản ứng và HNO3 còn dư sau khi phản ứng hoàn tất.
Vậy, sau phản ứng, ta thu được 0.126 mol Cu(NO3)2 và 0.112 mol H2O. Chất HNO3 dư 0.112 mol.
Ví dụ trên giúp hiểu rõ hơn về phản ứng giữa HNO3 và CuO, cách tính toán số mol và xác định sản phẩm tạo thành sau khi phản ứng diễn ra.
Xem thên: Phản ứng HNO3 ra NO2: Công thức, cơ chế và ứng dụng
Hy vọng thông qua việc tìm hiểu về phản ứng HNO3 + CuO, chúng ta đã có cái nhìn tổng quan về sự tương tác giữa các chất hóa học và các ứng dụng hữu ích của chúng trong cuộc sống và công nghiệp. Hóa học là một lĩnh vực rộng lớn và đa dạng, luôn đem lại những điều mới mẻ để khám phá và ứng dụng.Các bạn hãy đón đọc thêm những bài viết khác của ihoc để có thêm nhiều kiến thức hóa học hữu ích nhé!
Nguồn: https://luatduonggia.edu.vn
Danh mục: Tổng hợp
This post was last modified on 17/04/2024 18:11
Vận may của 4 con giáp đang ngày càng xuống dốc. Cuối tuần này (23-24/11),…
Con số cuối cùng trong ngày sinh dự đoán con người sẽ GIÀU CÓ, sống…
Cuối tuần này (23-24/11), 4 con giáp sẽ gặp nhiều may mắn và thành công…
Tử vi hôm nay – Top 3 con giáp thịnh vượng nhất ngày 22/11/2024
Con số may mắn hôm nay 22/11/2024 theo năm sinh: Chọn con số ĐẾN LỘC
Tử vi thứ Sáu ngày 22/11/2024 của 12 con giáp: Chó vui vẻ, Hổ may…