#2 Liên kết hoá học: Liên kết ion và liên kết cộng hóa trị
Có nhiều loại liên kết hóa học và lực liên kết các phân tử lại với nhau. Hai loại liên kết cơ bản nhất được đặc trưng là liên kết ion và liên kết cộng hóa trị.
Trong liên kết ion, các nguyên tử chuyển electron cho nhau. Liên kết ion cần ít nhất một người cho điện tử và một người nhận điện tử. Ngược lại, các nguyên tử có cùng độ âm điện chia sẻ các electron trong liên kết cộng hóa trị, bởi vì không nguyên tử nào ưu tiên hút hoặc đẩy các electron dùng chung.
Bạn đang xem: #2 Liên kết hoá học: Liên kết ion và liên kết cộng hóa trị
Liên kết ion là sự chuyển giao hoàn toàn của (các) electron hóa trị giữa các nguyên tử. Đó là một loại liên kết hóa học tạo ra hai ion tích điện trái dấu.
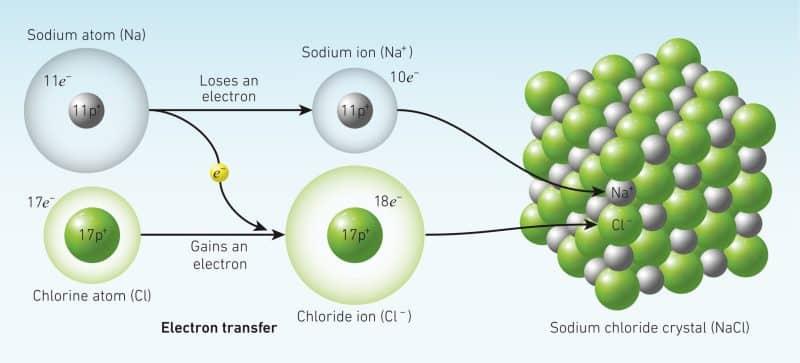
Trong liên kết ion, kim loại nhường bớt electron để trở thành cation mang điện tích dương. Ngược lại, phi kim nhận các electron đó để trở thành anion mang điện tích âm. Liên kết ion yêu cầu chất cho điện tử, thường là kim loại và chất nhận điện tử là phi kim.
Liên kết ion có được độ bền từ sự chênh lệch điện tích giữa hai nguyên tử, nghĩa là sự chênh lệch điện tích giữa cation và anion càng lớn thì liên kết ion càng mạnh.
Liên kết ion được quan sát bởi vì kim loại có ít electron trong quỹ đạo ngoài cùng của chúng. Bằng cách mất các electron đó, các kim loại này có thể đạt được cấu hình khí hiếm và đáp ứng quy tắc bát tử. (Các nguyên tố có cấu hình electron lớp ngoài cùng dạng: ns2 np6 trừ He là 1s2, được coi là khí hiếm thuộc nhóm VIIIA. Xem bảng tuần hoàn).
Tương tự, các phi kim có gần 8 electron trong lớp vỏ hóa trị của chúng có xu hướng dễ dàng nhận electron để đạt được cấu hình electron khí hiếm (Nhóm VIIIA).
Trong liên kết ion, nhiều hơn 1 electron có thể được tặng hoặc nhận để đáp ứng quy tắc bát tử. Các điện tích trên anion và cation tương ứng với số lượng electron được tặng hoặc nhận. Trong liên kết ion, điện tích ròng của hợp chất phải bằng không.
Xét ví dụ: Liên kết ion của muối NaCl
Năng lượng tổng thể dự đoán của quá trình liên kết ion, bao gồm năng lượng ion hóa của kim loại và ái lực điện tử của phi kim, thường dương, cho thấy rằng đây là phản ứng thu nhiệt và phản ứng bất lợi
Xem thêm : Bầu 3 tháng đầu ăn sầu riêng được không? Cần lưu ý gì?
Tuy nhiên, phản ứng này rất thuận lợi vì lực hút tĩnh điện giữa các phân tử. Ở khoảng cách lý tưởng giữa các nguyên tử, lực hút giữa các hạt này giải phóng đủ năng lượng để tạo điều kiện thuận lợi cho phản ứng.
Hầu hết các hợp chất ion có xu hướng phân ly trong dung môi phân cực vì chúng thường phân cực. Hiện tượng này là do các điện tích trái dấu trên mỗi ion.
Ví dụ 1: Muối magie clorua MgCl2
Trong ví dụ này, nguyên tử magiê đang tặng cả hai electron hóa trị của nó cho nguyên tử clo. Mỗi nguyên tử clo chỉ có thể nhận 1 electron trước khi đạt được cấu hình khí hiếm; do đó, cần có 2 nguyên tử clo để nhận 2 electron do magie tặng.
Liên kết cộng hóa trị là sự dùng chung electron giữa các nguyên tử. Loại liên kết này xảy ra giữa hai nguyên tử của cùng một nguyên tố hoặc của các nguyên tố gần nhau trong bảng tuần hoàn. Liên kết này xảy ra chủ yếu giữa các phi kim loại; tuy nhiên cũng có thể quan sát thấy giữa phi kim và kim loại.
Nếu các nguyên tử có độ âm điện tương tự nhau (cùng ái lực với các electron) thì liên kết cộng hóa trị dễ xảy ra nhất. Bởi vì cả hai nguyên tử đều có cùng ái lực với các electron và không có xu hướng tặng chúng, nên chúng chia sẻ các electron để đạt được cấu hình octet và trở nên ổn định hơn.
Ngoài ra, năng lượng ion hóa của nguyên tử quá lớn và ái lực điện tử của nguyên tử quá nhỏ để khiến liên kết ion xảy ra.
Bảng sau đây cho biết kim loại cần nhường bao nhiêu electron để có cấu hình electron giống như khí hiếm. Nó cũng cho biết phi kim cần thu hoặc chia bao nhiêu electron để có cùng cấu hình electron với khí hiếm.
Phân loại Nhóm Số electron hóa trị Số lượng điện tử bị mất, thu được hoặc chia sẻ kim loại 1 1 Mất 1 điện tử 2 2 Mất 2 electron 3 3 Mất 3 electron phi kim 15 5 nhận 3 electron hoặc cho đi 3e 16 6 nhận 2 electron hoặc cho đi 2e 17 7 nhận 1 electron hoặc cho đi 1e
Bảng cho thấy có một mối quan hệ giữa số nhóm, số lượng electron hóa trị và số lượng electron cần thiết để mất đi hoặc thu được. Kim loại nhóm 2 có hai electron lớp ngoài cùng và chúng cần mất hai electron hóa trị để có cấu hình electron giống như khí hiếm.
Tương tự, Các phi kim nhóm 16 có sáu electron hóa trị và chúng có xu hướng nhận hoặc chia sẻ hai electron để có tám electron hóa trị và cấu hình electron giống như khí hiếm.
Xem thêm : Thắp hương xong bao lâu thì hóa vàng?
Ví dụ 2: Carbon không hình thành liên kết ion vì nó có 4 electron hóa trị, bằng một nửa so với quy tắc octet. Để hình thành liên kết ion, các phân tử Carbon phải tăng hoặc giảm 4 electron.
Điều này rất bất lợi. Do đó, các phân tử carbon chia sẻ 4 electron hóa trị của chúng thông qua các liên kết đơn, đôi và ba để mỗi nguyên tử có thể đạt được cấu hình khí hiếm.
Liên kết cộng hóa trị bao gồm các tương tác của quỹ đạo sigma và pi hình thành nên liên kết pi và liên kết sigma. Do đó, liên kết cộng hóa trị dẫn đến sự hình thành liên kết đơn, đôi, ba và bốn.
Trong ví dụ này, Hai nguyên tử Hydro đang chia sẻ 2 electron (Nguyên tử Hydro tồn tại ở dạng H2) chưa ghép cặp của nó với Oxy. Cuối cùng, cả 3 phân tử này đều có 8 electron hóa trị và thỏa mãn quy tắc bát tử. Tương tự đối với CO2 và Nitơ.
Liên kết ion và cộng hóa trị là hai cực của liên kết. Cộng hóa trị có cực là loại liên kết trung gian giữa hai cực. Một số liên kết ion chứa các đặc tính cộng hóa trị và một số liên kết cộng hóa trị có một phần ion.
Ví dụ 3: hầu hết các hợp chất dựa trên carbon được liên kết cộng hóa trị nhưng cũng có thể là một phần ion.
Phân cực là thước đo sự phân tách điện tích trong hợp chất. Độ phân cực của một chất phụ thuộc vào tính đối xứng của hợp chất và sự khác biệt về độ âm điện giữa các nguyên tử.
Phân cực xảy ra khi các nguyên tố đẩy electron, được tìm thấy ở phía bên trái của bảng tuần hoàn, trao đổi electron với các nguyên tố hút electron, ở phía bên phải của bảng. Điều này tạo ra một phổ phân cực, với ion (cực) ở một cực, cộng hóa trị (không phân cực) ở một cực khác và cộng hóa trị có cực ở giữa.
Cả hai liên kết này đều quan trọng trong hóa học hữu cơ. Liên kết ion rất quan trọng vì chúng cho phép tổng hợp các hợp chất hữu cơ cụ thể. Các nhà khoa học có thể điều khiển các đặc tính ion và các tương tác này để tạo thành các sản phẩm mong muốn.
Liên kết cộng hóa trị đặc biệt quan trọng vì hầu hết các phân tử carbon tương tác chủ yếu thông qua liên kết cộng hóa trị. Liên kết cộng hóa trị cho phép các phân tử chia sẻ electron với các phân tử khác, tạo ra chuỗi hợp chất dài và cho phép phức tạp hơn trong cuộc sống.
Bài viết tiếp theo: #3 Liên kết hoá học: Liên kết kim loại
Nguồn: https://luatduonggia.edu.vn
Danh mục: Tổng hợp
This post was last modified on 09/02/2024 19:18
Con số may mắn hôm nay 23/11/2024 theo năm sinh: Nhặt TIỀN từ con số…
Tử vi thứ bảy ngày 23/11/2024 của 12 con giáp: Tuổi Thìn chán nản, tuổi…
Vận may của 4 con giáp đang ngày càng xuống dốc. Cuối tuần này (23-24/11),…
Con số cuối cùng trong ngày sinh dự đoán con người sẽ GIÀU CÓ, sống…
Cuối tuần này (23-24/11), 4 con giáp sẽ gặp nhiều may mắn và thành công…
Tử vi hôm nay – Top 3 con giáp thịnh vượng nhất ngày 22/11/2024