Các loại hợp chất vô cơ lớp 9
Các loại hợp chất vô cơ được biên soạn gửi tới bạn đọc là nội dung hệ thống các loại hợp chất vô cơ lớp 9, giúp bạn đọc biết hợp chất vô cơ có mấy loại, cũng như tính chất của các hợp chất vô cơ như thế nào?. Từ đó vận dụng giải các dạng câu hỏi bài tập liên quan
>> Mời các bạn tham khảo thêm tài liệu liên quan
Bạn đang xem: Các loại hợp chất vô cơ lớp 9
Hợp chất vô cơ là hợp chất hóa học mà trong phân tử không có chứa nguyên tử cacbon. Một số trường hợp ngoại lệ mà hợp chất được gọi là hợp chất vô cơ trong phân tử vẫn chứa nguyên tử cacbon là khí CO, khí CO2, axit H2CO3 và các muối cacbonat, hidrocacbonat.
Hợp chất vô cơ được phân loại thành từng nhóm dựa vào tính chất hóa học của những hợp chất đó tương tự nhau. Khi đó, người ta xếp chúng vào một nhóm để tiện nghiên cứu, học tập.
4 loại hợp chất vô cơ chính đó là: Oxit, Axit, Bazơ và Muối.
Oxit là hợp chất tạo bởi hai nguyên tố, trong đó có một nguyên tố là oxi
CTTQ: MxOy Gồm có kí hiệu oxi O kèm theo chỉ số y và kí hiệu nguyên tố M (có hóa trị n) chỉ số x, theo quy tắc hóa trị ta có: 2. y = n . x
Phân loại oxit
Chia thành 2 loại chính: Oxit axit và oxit bazơ
1. Oxit axit.
a) Thường là oxit của phi kim tương ứng với một axit.
Thí dụ: SO3 tương ứng với H2SO4
b) Cách gọi tên oxit axit
Để gọi tên oxit axit, người ta sẽ gọi theo công thức như sau:
Tên oxit axit: (tên tiền tố chỉ số nguyên tử của phi kim) + tên phi kim + (tên tiền tố của chỉ số nguyên tử oxi) + “Oxit
Chỉ sốTên tiền tốVí dụ1Mono (không cần đọc đối với những hợp chất thông thường)2ĐiCO2: cacbon đioxit3TriSO3: Lưu huỳnh trioxit4Tetra5PentaN2O5: Đinitơ pentaoxit6Hexa7HepaMn2O7: Đimangan heptaoxit
>> Theo chương trình SGK Hóa học MỚI
Đối với oxide của phi kim (hoặc acidic oxide – oxit axit của kim loại):
CÁCH 1: Tên phi kim + (Hóa trị) + Oxide
CÁCH 2: Số lượng nguyên tử + Tên nguyên tố + Số lượng nguyên tử Oxygen + Oxide
Lưu ý: Số lượng nguyên tử/ nhóm nguyên tử được quy ước là mono /mô-nầu/, di /đai/, tri /trai/, tetra /tét-trờ/, penta /pen-tờ/,…
Theo quy tắc giản lược nguyên âm: mono-oxide = monoxide, penta-oxide = pentoxide.
Ví dụ: SO2: sulfur (IV) oxide – /sâu-phờ (phor) óoc-xai-đ/ hay sulfur dioxide – /sâu-phờ đai-óoc-xai-đ/
CO: carbon (II) oxide – /ka-bần (tuu) óoc-xai-đ/ hay carbon monoxide – /ka-bần mô-nâu-xai-đ/
P2O5: phosphorus (V) oxide – /phoos-phờ-rợs (phai) óoc-xai-đ/ hay diphosphorus pentoxide – /đai-phoos-phờ-rợs pen-tờ-xai-đ/
CrO3: chromium (VI) oxide – /krâu-mi-um (sik) óoc-xai-đ/ hay chromium trioxide – /krâu-mi-um trai-óoc-xai-đ/
c) Tính chất hóa học của oxit axit
Hầu hết các oxit axit khi hòa tan vào nước sẽ cho ra dung dịch oxit (trừ SiO2)
P2O5 + 3H2O → 2H3PO4
Khi cho oxit axit tác dụng với oxit bazơ tan sẽ tạo ra muối (thường là những oxit có thể tác dụng được với nước)
CO2 + CaO → CaCO3
Bazơ tan là bazơ của kim loại kiềm cùng kiềm thổ mới. Cụ thể, có 4 bazơ tan như: NaOH, KOH, Ca(OH)2 và Ba(OH)2
CO2 + NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
Khi cho oxit axit tác dụng với dung dịch kiểm để xác định sản phẩm sau phản ứng tạo thành muối axit hay muối trung hòa tại: Chuyên đề: CO2 tác dụng với dung dịch kiềm
2. Oxit bazơ
a) Thường là oxit của kim loại tương ứng với một bazo
Ví dụ: Na2O tương ứng với bazo NaOH
b) Cách gọi tên Oxit bazơ
Tên oxit: Tên nguyên tố + oxit
Ví dụ: BaO: Bari oxit
Tên oxit: Tên kim loại ( kèm hóa trị) + oxit
>> Theo chương trình Hóa học Mới
– “oxide” – /ˈɒksaɪd/ hay /ˈɑːksaɪd/ – “óoc-xai-đ”
– Đối với oxide của kim loại (hướng đến basic oxide – oxit bazơ):
TÊN KIM LOẠI + (HÓA TRỊ) + OXIDE
Ví dụ: Na2O: sodium oxide – /ˈsəʊdiəm ˈɒksaɪd/ – /sâu-đì-ầm óoc-xai-đ/.
MgO: magnesium oxide – /mæɡˈniːziəm ˈɒksaɪd/ – /mẹg-ni-zi-ầm óoc-xai-đ/.
c. Tính chất hóa học của Oxit bazơ
Một số Oxit bazo tác dụng với nước tạo thành dung dịch bazo (kiềm)
Na2O + H2O (dd) → 2NaOH
Một số oxit bazo khác tác dụng với nước như: K2O, Li2O, Rb2O, Cs2O, SrO,…
Oxit bazo tác dụng với axit tạo thành muối và nước
CaO + 2HCl → CaCl2 + H2O
Một số oxit bazo (là những oxit bazo tan trong nước) tác dụng với oxit axit tạo thành muối
Ví dụ: CaO + CO2 → CaCO3
1. Phân loại
Dựa vào tính chất hóa học, phân loại thành:
2. Tính chất hóa học của axit
a. Tác dụng với chất chỉ thị màu
Dung dịch axit làm quỳ thành đỏ
b. Tác dụng với kim loại
Xem thêm : Giải mã bí ẩn của khăn ướt vịt vàng sự thật về công năng và hiệu quả thực sự!
Axit + kim loại hoạt động → muối + H2 ↑
Ví dụ:
2HCl + Fe → FeCl2 + H2 ↑
Kim loại (Au, Pt) + → Muối HT cao + H2O +
Ví dụ:
3Fe + 4HNO3 loãng → Fe(NO3)3 + 2H2O + NO ↑
c. Tác dụng với bazơ
Axit + bazơ → muối + nước
Ví dụ:
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
d. Tác dụng với oxit bazơ
Axit + oxit bazơ → muối + nước
Lưu ý: Các axit có tính oxi hóa mạnh (HNO3, H2SO4 đặc) khi tác dụng với các hợp chất oxit, ba zơ, hoặc muối của kim loại có hóa trị chưa cao thì sản phẩm như khi tác dụng với kim loại.
Ví dụ:
Fe2O3 + 2HNO3 → 2Fe(NO3)3 + H2O
e. Tác dụng với muối
Axit + muối → axit mới + muối mới
f. Tác dụng với phi kim rắn: C, P, S (xảy ra đối với axit có tính oxi hóa mạnh: H2SO4 đặc, HNO3)
Phi kim + → Axit của PK + nước +
Ví dụ:
S + 2H2SO4 (đ,n) → 3SO2 + H2O
3. Phương pháp điều chế trực tiếp
a) Đối với axit có oxi
Oxi axit + nước → axit tương ứng
SO3 + H2O → H2SO4
Axit + muối → muối mới + axit mới
BaCl + H2SO4 → BaSO4 + HCl
Một số PK rắn → axit có tính oxi hóa mạnh
b) Đối với axit không có oxi
Phi kim + H2 → hợp chất khí (Hòa tan trong nước thành dung dịch axit)
Halogen (F2, Cl2, Br2,…) + nước
2F2 + 2H2O → 4HF + O2 ↑
Muối + Axit → muối mới + axit mới
Ví dụ: Na2S + H2SO4 → H2S ↑ + Na2SO4
1. Phân loại bazơ
Dựa vào tính tan của bazơ trong nước, người ta chia tính baz ơ thành 2 loại:
NaOH, KOH, Ba(OH)2, Ca(OH)2, LiOH, RbOH, CsOH, Sr(OH)2.
Cu(OH)2, Mg(OH)2, Fe(OH)3, Al(OH)3…
2. Cách gọi tên bazơ
Tên bazo = Tên kim loại (thêm hóa trị nếu kim loại có nhiều hóa trị) + hidroxit
Xem thêm : Hình bình hành là gì? Dấu hiệu nhận biết hình bình hành?
Thí dụ:
NaOH – Natri hidroxit
Fe(OH)3 – Sắt (III) hidroxit
>> Theo chương trình SGK mới
– “base” – /beɪs/ – /bêi-s/
– “hydroxide” – /haɪˈdrɒksaɪd/ hay /haɪˈdrɑːksaɪd/ – /’hai-đrooc-xai-đ/
– Cách gọi tên:
TÊN KIM LOẠI + (HÓA TRỊ) + HYDROXIDE
Ví dụ:
Ba(OH)2: barium hydroxide – /be-rì-ầm hai-đrooc-xai-đ/
Fe(OH)3: iron (III) hydroxide – /ai-ần (thri) hai-đrooc-xai-đ/ hay ferric hydroxide – /phe-rik hai-đrooc-xai-đ/
Fe(OH)2: iron (II) hydroxide – /ai-ần (tuu) hai-đrooc-xai-đ/ hay ferrous hydroxide – /phe-rợs hai-đrooc-xai-đ/
3. Tính chất hóa học của bazơ
a) Tác dụng với chất chỉ thị màu.
b) Dung dịch bazơ tác dụng với oxit axit tạo thành muối và nước.
Xem thêm : Hình bình hành là gì? Dấu hiệu nhận biết hình bình hành?
Thí dụ:
2NaOH + SO2 → Na2SO3 + H2O
c) Bazơ (tan và không tan) tác dụng với axit tạo thành muối và nước.
Xem thêm : Hình bình hành là gì? Dấu hiệu nhận biết hình bình hành?
Thí dụ:
KOH + HCl → KCl + H2O
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O
d) Dung dịch bazơ tác dụng với nhiều dung dịch muối tạo thành muối mới và bazơ mới.
Xem thêm : Hình bình hành là gì? Dấu hiệu nhận biết hình bình hành?
Thí dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
e) Bazơ không tan bị nhiệt phân hủy thành oxit và nước
Tạo thành oxit tương ứng và nước.
2Fe(OH)3 Fe2O3 + 3H2O
1. Định nghĩa
Muối là hợp chất mà phân tử gồm có một hay nhiều nguyên tử kim loại liên kết với 1 hay nhiêu gốc axit
2. Tên gọi
Tên muối = Tên kim loại ( thêm hóa trị nếu kim loại có nhiều hóa trị) + tên gốc axit
Ví dụ:
KNO3 – Kali nitrat
CaCO3 – Canxi cacbonat
>> Theo chương trình SGK mới
[Tên nguyên tố đứng đầu Ammonium (NH4) /əˈməʊniəm/ + Tên gốc muối
Tên gốc muối gồm:
+ Gốc không chứa oxygen → Đuôi ide /aid/
+ Gốc chứa oxgen, hóa trị thấp → đuôi ite /aɪt/
+ Gốc chứa oxygen, hóa trị cao → Đuôi ate /eɪt/
Ví dụ:
GỐC MUỐI
TÊN GỐC
PHIÊN ÂM
VÍ DỤ
F
-fluoride
/ˈflɔːraɪd/
/ˈflʊəraɪd/
/ˈflʊraɪd/
NaF: sodium fluoride /sâu-đì-ầm flo-rai-đ/
SF6: sulfur hexafluoride /sâu-phờ hek-xờ flo-rai-đ/
3. Phân loại
Muối trung hòa là muối trong gốc không có hidro
Ví dụ: Na2CO3, KNO3
Muối axit là muối trong gốc có hidro
Ví dụ: NaHCO3
4. Tính chất hóa học của muối
a. Muối tác dụng với kim loại
Muối + kim loại → Muối mới + kim loại mới
Fe + CuSO4 → FeSO4 + Cu
b. Muối tác dụng với axit
Muối + axit → muối mới + axit mới
HCl + 2AgNO3 → AgCl + HNO3
c. Muối tác dụng với muối
Muối + muối → 2 muối mới
NaCl + AgNO3 → NaNO3 + AgCl
d. Muối tác dụng với bazơ
Muối + bazơ → muối mới + bazơ mới
2KOH + CuCl2 → 2KCl + Cu(OH)2
e. Phản ứng nhiệt phân
Một số muối bị nhiệt phân hủy ở nhiệt độ cao
CaCO3 CaO + CO2
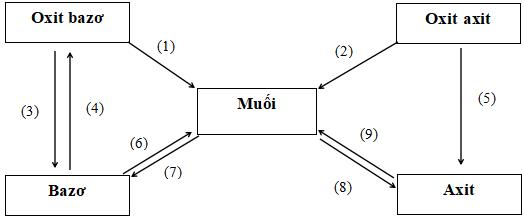
Phản ứng hóa học minh họa
(1) ZnO + 2HCl → ZnCl2 + H2
(2) CO2 + Ca(OH)2 → CaCO3 + H2O
(3) Na2O + H2O → 2NaOH
(4) Fe(OH)2 FeO + H2O
(5) P2O5 + 3H2O → 2H3PO4
(6) Ba(OH)2 + H2SO4 → BaSO4 + H2O
(7) CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
(8) AgNO3 + HCl → AgCl + HNO3
(9) H2SO4 + ZnO → ZnSO4 + H2O
………………………………………..
Trên đây VnDoc đã đưa tới các bạn Các loại hợp chất vô cơ lớp 9. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 9, Chuyên đề Vật Lí 9, Chuyên đề Hóa 9, Tài liệu học tập lớp 9 mà VnDoc tổng hợp và đăng tải.
Nguồn: https://luatduonggia.edu.vn
Danh mục: Tổng hợp
This post was last modified on 14/02/2024 18:36
Con số may mắn hôm nay 23/11/2024 theo năm sinh: Nhặt TIỀN từ con số…
Tử vi thứ bảy ngày 23/11/2024 của 12 con giáp: Tuổi Thìn chán nản, tuổi…
Vận may của 4 con giáp đang ngày càng xuống dốc. Cuối tuần này (23-24/11),…
Con số cuối cùng trong ngày sinh dự đoán con người sẽ GIÀU CÓ, sống…
Cuối tuần này (23-24/11), 4 con giáp sẽ gặp nhiều may mắn và thành công…
Tử vi hôm nay – Top 3 con giáp thịnh vượng nhất ngày 22/11/2024